
Fig1:CAR-NK的治疗过程
CAR-NK细胞免疫治疗所用细胞的来源主要为患者自身外周血NK细胞,涉及采集NK细胞进行无菌分离、体外扩增后制成静脉输注制品等过程。该制备过程需要遵循GMP操作规范,保证细胞制品的安全性。
1. 所用理化消毒试剂符合药典标准,无残留毒性。
2. 无血源性病原体污染风险,HIV、HBV、HCV、梅毒螺旋体等严格筛查。
3. 无污染细胞存在,纯度高。
4. 功能检测验证NK细胞的活性、无毒性检测。
5.质量系统全过程控制,确保制备过程稳定一致。
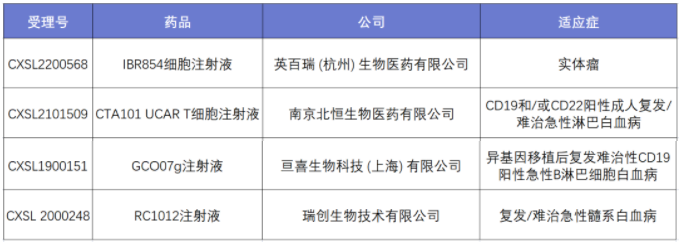
CAR-NK疗法本身具有独特的抗肿瘤效应,不受MHC限制的细胞毒性、产生细胞因子和免疫记忆等特点,在已有的生产规范加持下,CAR-NK已被各大药企认为最有希望成功商业化的“通用型”抗癌产品。CDE官网显示,上海先博生物科技有限公司提交的CD19 CAR-NK 细胞疗法IND申请获CDE受理。但事实上这不是我国企业的第一次尝试,英百瑞生物医药有限公司自主研发的英百瑞IBR854细胞注射液临床试验申请获得国家药监局受理,为国内首个针对实体瘤的非基因编辑方法的通用型CAR-NK细胞药物。

Fig2:先博生物公司的CDE申请信息

Fig3:英百瑞公司的CDE申请信息
通用型免疫细胞治疗产品的细胞来源为异体,尤其需要关注起始原材料的安全性问题。这要求企业建立合理的供者筛选程序和标准,并尽量收集供者的相关特征,还需筛查供者是否存在乙型肝炎病毒 (Hepatitis B virus,HBV)、丙型肝炎病毒(Hepatitis C virus, HCV)、人类免疫缺陷病毒 (Human immunodeficiency virus,HIV)、梅毒螺旋体等感染。技术导向的Nkarta公司为了加速CAR-NK通用型的商业化过程,建立了专有现货型NK细胞治疗平台旨在通过有效免疫细胞的强劲扩张、增强的靶向性和延长的持久性,最大限度地提高同种异体NK细胞的治疗效果,从而释放出强大而持久的抗癌免疫介导攻击。

Fig4:Nkarta的NK细胞治疗平台
➤我国目前的通用型免疫细胞疗法
同立海源生物作为国内专注细胞与基因治疗上游GMP级核心原料生产企业,公司细胞培养技术开发平台专为客户打造细胞培养整体解决方案。公司自主研发生产的AMMS® NK试剂盒套装适用于采用自体外周血或脐血细胞中分离得到的单个核细胞,经体外操作使NK细胞活化扩增,最终得到高纯度高效应的NK细胞。经过大量的测试数据验证,该款试剂盒处于国内领先地位。另外该套装已通过美国FDA的DMF II类备案(备案号: 035588),支持CAR-NK细胞药物申报注册。
◎ 纯因子法,无血清,无需饲养细胞
◎ 活化和扩增效率高,性能领先
◎ 适用于外周血或脐带血单个核细胞
◎ 批次稳定性高、药用级别原辅料
◎ 美国FDA DMF备案
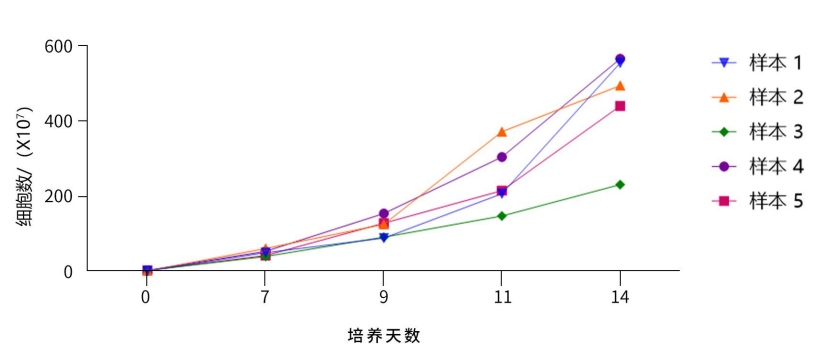
◎NK总细胞扩增变化
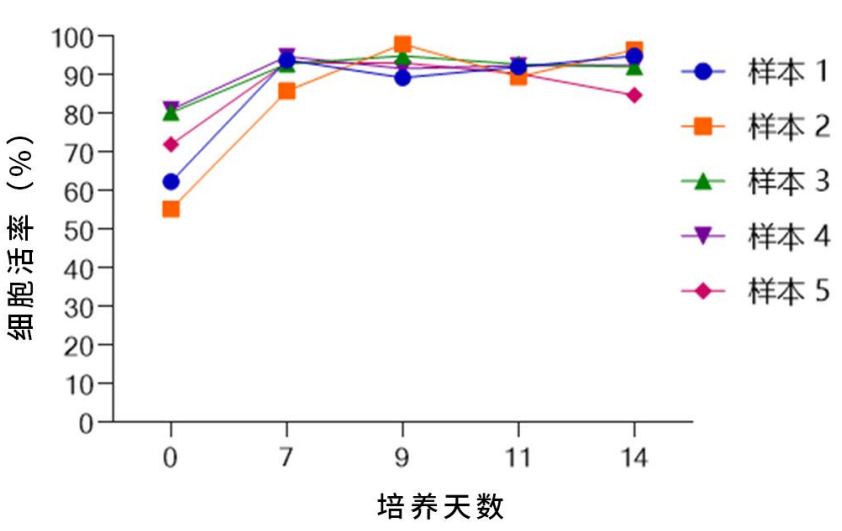
◎NK细胞活率变化
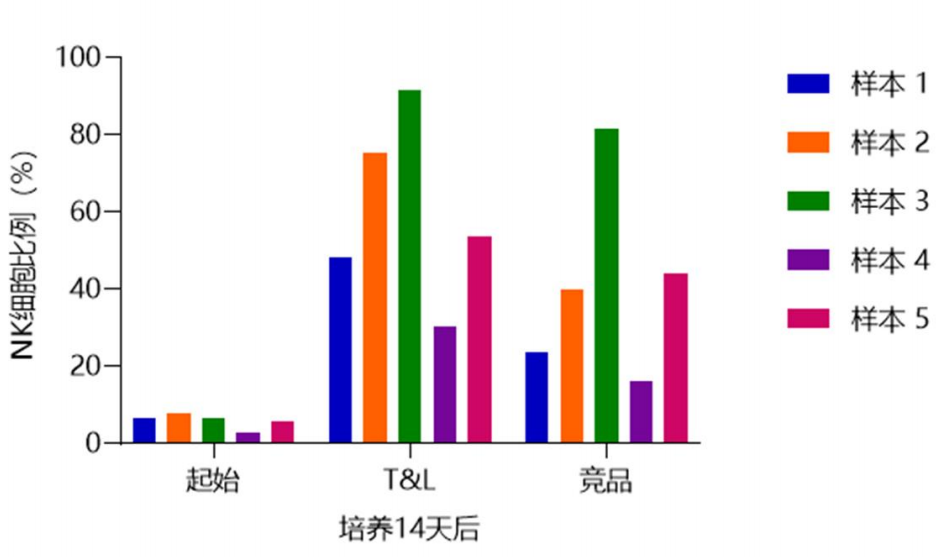
◎NK细胞扩增比例
关于同立海源
北京同立海源生物科技有限公司,专注细胞和基因治疗(CGT)上游GMP级原料试剂研发及生产,为CGT用户提供产品与服务的整体解决方案。产品涉及细胞分选磁珠试剂、真核/原核重组蛋白、无血清培养基、细胞培养试剂盒等。
公司建有3200㎡的研发实验室及GMP级洁净车间,包括细胞分选磁珠开发平台、真核与原核蛋白表达工程平台、无血清培养基开发平台,通过ISO13485和ISO9001双质量体系认证,部分产品已获美国FDA DMF备案。
