
NK细胞无需抗原预先致敏,即可快速反应并同时激活免疫系统来协同发挥杀伤作用,堪称免疫细胞里的航空母舰。科学家对NK细胞疗法也寄予厚望,全球的NK细胞相关疗法也在如火如荼的进行着。如何高效利用NK细胞帮助我们战胜疾病,科学家们为此一直在努力着,今天我们就来系统的了解一下如何在各个环节提高NK细胞的纯度,以达到最好的治疗效果。
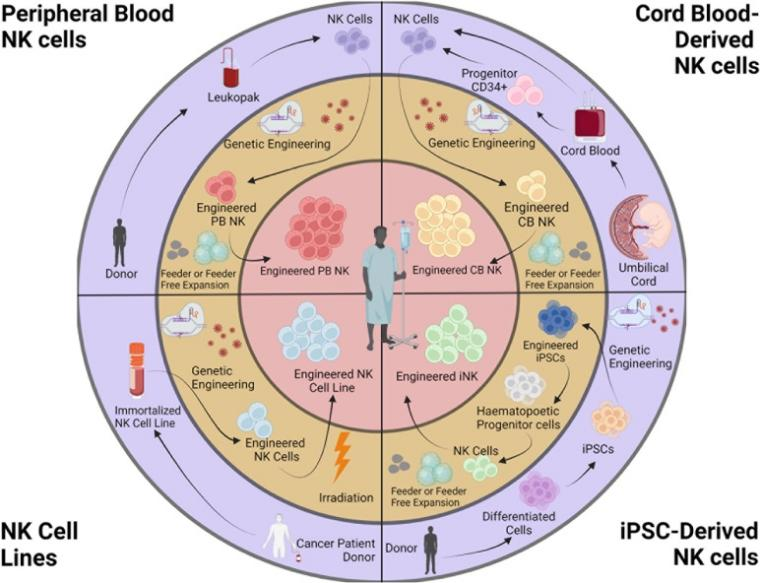
Fig1:NK 细胞的来源
首先我们需要了解NK细胞是一种自然免疫细胞,广泛存在于人体的外周血、骨髓、脾、淋巴结等组织中。在细胞来源方面,外周血中的NK细胞含量较高,是常用的来源之一【1】,另外脐带血产业在近几年迅速发展,也成为NK细胞主要来源之一。除此之外,也可以从人体骨髓、脾、淋巴结等组织中获得NK细胞,但这些来源的细胞数较少,需要经过特殊处理才能得到足够的细胞量。
首先,需要从健康人体中采集血样进行实验。为了避免血液的凝固和失活,建议在血样采集后尽快进行处理。外周血采集建议首选肝素钠采血管,最好在采血后4小时内安排分离实验。而采集脐血无法选用采血管,必须用采血袋,建议使用抗凝剂较少的采血袋(比如100ml的袋子内含14ml抗凝保存液),以更大程度防止血钙流失。血液处理可以使用Ficoll梯度离心分离法(以外周血为例),具体方法如下:
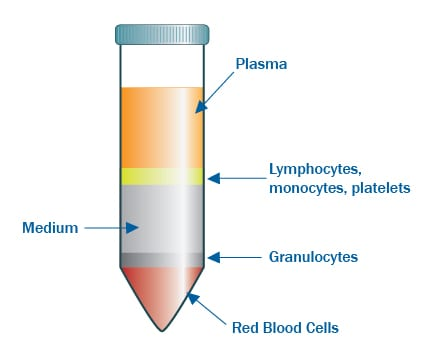
Fig2:梯度离心分离法
1、将采集的外周血室温下进行离心处理(操作前请进行检菌),离心15分钟,离心速度设置为750g左右。此时,血液将被分为两个层次:上层为血浆,下层为白细胞、红细胞和粘稠物。
2、自体血浆分离
2.1 操作1离心结束后用移液管将上层血浆转入离心管进行密封灭活(血浆放入水浴锅56℃灭活半小时),灭活后的血浆置于4℃冰箱半小时,防止补体、血小板等对细胞活化产生影响;
2.2 取出冰箱血浆进行再次离心,离心10分钟,离心速度1000g左右,取上清作为自体血浆置于4℃冰箱备实验需用。
3、单个核细胞PBMC分离
3.1 操作1离心结束后获得的血细胞沉淀用等体积生理盐水重悬混匀,然后将混匀的血细胞缓慢加入到离心管中Ficoll层上(确保分层清晰);
3.2 将离心管放入离心机进行离心处理,离心25分钟,离心速度930g左右,离心结束后弃去上清并吸取白膜层细胞(尽量吸尽液面交界处的细胞层)
3.3 吸取到的白膜层细胞放入新的离心管,用生理盐水重悬混匀定容至100mL并进行离心处理,离心8分钟,离心速度750g;
3.4 可再次洗涤细胞。弃上清,重悬细胞,吸取少量细胞计数。调整细胞密度后种瓶。
为了提高NK细胞的杀伤活性,需要在细胞培养基中添加一些刺激剂,如IL-2、IL-15等。IL-2和IL-15的加入可以促进NK细胞的增殖和分化,同时提高细胞的杀伤活性。在激活NK细胞时,我们将其培养在含有IL-2和IL-15的培养基中,以促进细胞的增殖和活化。不过值得注意的是,从PBMCs诱导培养也会刺激CD3+ T和NKT(CD3+CD56+)细胞的扩增。因此,基于异体移植可能引起的T细胞介导的同种异体反应性,可以考虑提前通过磁分选消除其他免疫细胞,以便培养可以获得高纯度的NK细胞,这也是CAR-NK细胞制备获得高纯度细胞的关键。
实验内容如下:
1、完全培养基配置:1L培养基加入IL-2,终浓度为 1000IU/mL。
2、细胞计数:用少量完全培养基重悬细胞(PBMCs),吸取少量细胞计数。调整细胞密度1.5-2×106 个/mL。
3、种瓶:将细胞悬液中加入激活因子和灭活血浆,转入培养瓶内,培养终体积约 25mL(为了更有效刺激NK细胞激活,可提前采用包被液包被培养瓶)。
4、将培养瓶放入37℃、5% CO2的细胞培养箱中培养,在培养期间每隔一天补充一次培养基。
5、培养7天后,我们将细胞悬液转移到培养袋继续培养。
当NK细胞被激活时,检测的维度是多样的,可以检测活性、杀伤毒性等等,常见的方法有以下三种:
1.流式细胞术(Flow cytometry):流式细胞术是一种常用的检测方法,可以通过检测表面标记物和内部蛋白来确定细胞类型和功能。通过使用特定的抗体,可以检测到激活的NK细胞表面上的活化标记物,如CD16、CD56、和CD137等。
2.细胞活性测定(Cellular cytotoxicity assay):细胞活性测定可以评估NK细胞的杀伤能力。在这种测试中,将被测细胞与肿瘤细胞共同培养,然后测量肿瘤细胞的死亡率。如果激活的NK细胞对肿瘤细胞有杀伤作用,那么肿瘤细胞死亡率将会升高【2】。
3.酶联免疫吸附测定(Enzyme-linked immunosorbent assay,ELISA):ELISA可以检测细胞因子和其他蛋白质的表达水平。在NK细胞激活的情况下,细胞因子如干扰素-γ(IFN-γ)、肿瘤坏死因子-α(TNF-α)和粒细胞巨噬细胞集落刺激因子(GM-CSF)等会被分泌出来。通过检测这些分泌的细胞因子水平,可以评估NK细胞的激活状态。
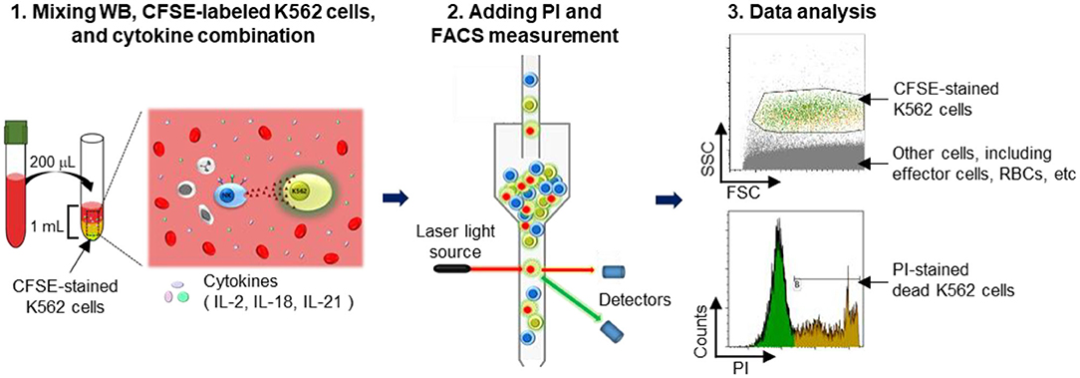
Fig3:NK细胞毒性测定
在完成刺激激活之后,NK细胞需要进行扩增培养,以增加其数量和活性,以便进行后续的实验和应用。在培养NK细胞时,我们需要选择合适的培养基和培养条件,以促进细胞的生长和分化。最常用的培养基是无血清免疫细胞培养基,其中包含必需氨基酸、维生素和微量元素等营养物质。此外,还可以添加一些生长因子,如白细胞介素-2(IL-2),以促进NK细胞的生长和扩增。在一些研究中,还会添加一些其他的细胞因子,如白细胞介素-12(IL-12)、白细胞介素-15(IL-15)、白细胞介素-18(IL-18)、白细胞介素-21(IL-21)等,以提高NK细胞的细胞毒性和杀伤作用。
其中IL-2在短时间内可促进NK细胞的存活、并激活提高细胞毒性。主要由于IL-2刺激PBMCs可导致淋巴因子激活的杀伤细胞LAK数量增加(LAK前体细胞是由NK细胞和T细胞组成),因此对自体肿瘤细胞具有较高的杀伤能力;其次IL-2和IL-15联合应用可促进NK细胞的增殖和活性,更有利于NK细胞的激活,特别的是IL-2和IL-15联用可诱导NK细胞活化受体NKG2D、NKp44、NKp30和NKp46的表达,提高其对肿瘤细胞株的细胞毒性;研究表明IL-12也可用于体外NK细胞培养,刺激NK细胞产生IFN-γ;另外IL-12、IL-15和IL-18联合可以诱导细胞因子诱导的记忆样NK细胞(CIML),CIML是一种寿命长、细胞毒性高、分泌IFN-γ的细胞。CIML-NK细胞已在小鼠肿瘤模型中进行过继免疫治疗,并显示出抗黑色素瘤和淋巴瘤的良好效果;白细胞介素-21是一种四螺旋束的细胞因子,对淋巴细胞和骨髓细胞具有多种生物学效应,能诱导NK细胞的成熟,并增强其细胞毒性,并且IL-21与IL-2或IL-15组合能诱导NK细胞的增殖,对NK 细胞产生调节作用。
在扩增培养过程中,我们还需要注意一些关键的指标,如细胞密度、细胞存活率和细胞表面标志物的表达情况等。通常,NK细胞的最佳扩增密度为1-2×106/mL。为了保证细胞的生长和分化,我们需要每2-3天补充新的培养基,并添加适量的生长因子和自体血浆。除了培养基、生长因子和自体血浆之外,还需要注意细胞培养的温度、湿度和二氧化碳浓度等条件。NK细胞的最佳培养条件为37℃、5% 二氧化碳。在扩增培养过程中,我们还需要检测细胞的活性和表面标志物的表达情况,以确保细胞的质量和适用性。最常用的检测方法是流式细胞术,通过特定的荧光标记物和抗体,可以对细胞表面标志物的表达情况进行检测和分析。
结语:科学家们为了在鱼龙混杂的体系之中提纯出NK细胞进行了数十年的研究,我们从上文的方法可以看出各种方法都存在自己的优越性以及局限性,这就需要我们学会理性分析自己的需求特点,选择合适的提纯方案,并在实践中不断优化和改进技术。我国的NK细胞疗法起步虽然略慢,但是我们充分利用了产业模式以及广纳最新的科学技术,发展出许多NK细胞提纯的平台,为我国NK细胞相关研究和应用保驾护航。在疫情阴霾完全散去的今天,我国的免疫治疗领域正如NK细胞本身一样,在监管反应和协同方面同时发力,为战胜疾病贡献自己的力量。
同立海源生物研发生产的GMP级IL-2、IL-12、IL-15、IL-18、IL-21均可满足NK/CAR-NK细胞药物开发、验证、申报等不同阶段的需求。
公司生产车间是万级C+A洁净车间,制剂车间按照B级无菌制剂要求灌装,制剂采用药用辅料;
公司执行ISO13485、ISO9001质量管理体系,保障物料及过程的可控性与可追溯性。
《药品生产质量管理规范(2010年修订)》
《GMP 附录-细胞治疗产品》(征求意见稿)
《中国药典》
➤ 采用无动物源性材料生产和药用辅料制剂
➤ 无菌、无氨苄抗生素、无HBV、HCV、HIV等病原体、无支原体
➤ 内毒素低于10EU/mg、宿主蛋白残留低于0.005%、外源性DNA残留低于100pg/mg
➤ 活性高、纯度高、稳定性高
➤ 批间一致性好
➤ 药用西林瓶包装
产品信息 >>
参考文献:
【1】Rossi F, Fredericks N, Snowden A, Allegrezza MJ, Moreno-Nieves UY. Next Generation Natural Killer Cells for Cancer Immunotherapy. Front Immunol. 2022 Jun 2;13:886429.
【2】 Kim J, Phan MT, Kweon S, Yu H, Park J, Kim KH, Hwang I, Han S, Kwon MJ, Cho D. A Flow Cytometry-Based Whole Blood Natural Killer Cell Cytotoxicity Assay Using Overnight Cytokine Activation. Front Immunol. 2020 Aug 14;11:1851.
【3】 Kim TJ, Kim M, Kim HM, Lim SA, Kim EO, Kim K, Song KH, Kim J, Kumar V, Yee C, Doh J, Lee KM. Homotypic NK cell-to-cell communication controls cytokine responsiveness of innate immune NK cells. Sci Rep. 2014 Dec 5;4:7157.