1月30日CDE通过了杭州厚无生物医药科技有限公司和广东天科雅生物医药科技有限公司提交的"HV-101注射液"获得临床试验默示许可,用于治疗晚期复发或者转移性实体瘤。这是目前国内第四款获得IND审批的TIL(tumor infiltrating lymphocyte)药物,在此两天前广州智瓴生物医药有限公司的ZLT-001注射液刚作为第三款TIL药物获得审批。过继细胞免疫疗法对于大众可能是一个陌生的名词,但是说到一针天价的抗癌神器CAR-T,相信不少人都会恍然大悟。得益于媒体的宣传,免疫疗法已经进入了大众的视野,但是过继细胞免疫疗法是一个庞大的家族,前文提到的CAR-T疗法目前主要应用于血液肿瘤,对于病人基数更广泛、治疗难度更大的实体瘤来说, TIL疗法或许才是最有希望的救星。
人体肿瘤组织内浸润了大量的T细胞,这些T细胞中存在部分针对肿瘤特异性抗原的T细胞,可以深入肿瘤组织内部杀伤肿瘤,这些细胞被称为TIL即肿瘤浸润淋巴细胞。以此为原理科学家们开发了TIL疗法用于攻克实体瘤,TIL的产生可分为两个步骤:快速扩增前程序pre-REP,以及耗时14天的REP过程【1】,将肿瘤组织中的T细胞分离出,在体外进行刺激扩增,这个过程尤为关键的地方是为了保证增殖能力,需要使用特定的培养基。早期实验是添加大量的IL-2进行扩增,但是科学家们发现这样会导致肿瘤免疫逃逸发生。随后经过长期探索制定了除使用IL-2外,需添加细胞因子IL-7、IL-12、IL-15以及单克隆抗体CD3、CD134以及PD-1的扩增模式。TIL扩增这一步骤十分关键,在很大程度上决定了后续治疗的效果以及不良反应的控制。在细胞增殖达到我们需要的数量级时回输到患者体内,从而扩大免疫应答,治疗原发或继发肿瘤。
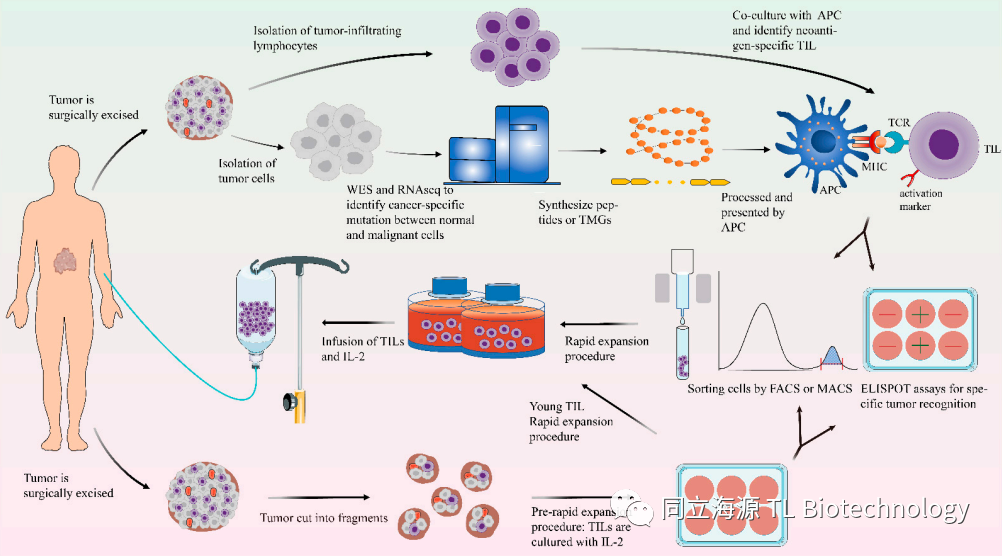
Fig1. TIL疗法的基本步骤
相比于其他的细胞疗法,TIL疗法拥有更明显的优势。首先TIL疗法的免疫细胞来自于肿瘤组织,而其他细胞免疫疗法大部分来源取自血液,这直接决定了TIL细胞具有更强的肿瘤识别能力。另一方面,TIL疗法由具有多个T细胞抗原受体(TCR)克隆的T细胞组成,能够识别一系列肿瘤抗原。TIL疗法这些优势解决了实体瘤具有高度异质性肿瘤抗原的难题,弥补了目前免疫治疗无法攻克实体瘤的空白。
TIL疗法领域的龙头企业当属总部位于San Carlos的Iovance,公司从TIL疗法奠基人Steve Rosenberg教授手中获得了包括化合物和生产技术等多项相关专利许可,同时抓住了唯快不破的原则,开发了GMP生产流程,将整个过程缩短至22天,极大的提高了治疗效率。公司官网公布了TIL管线研发还涉及TIL联合用药方案覆盖多种癌症,进一步扩大自身的商业版图。

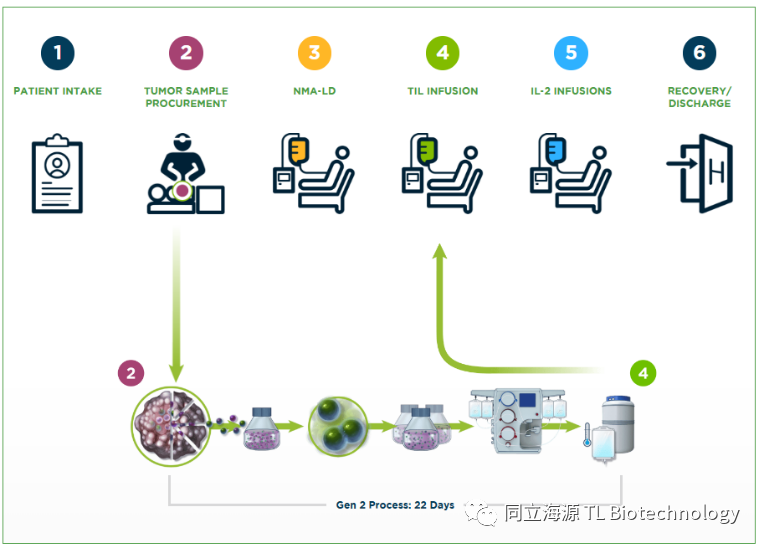

 Fig2. Iovance官网展示的TIL疗法过程以及在研管线
Fig2. Iovance官网展示的TIL疗法过程以及在研管线
在美国的另一边,立足于Dallas的Instil Bio公司于2018年成立,研发了使用共刺激抗原受体(Co-Stimulatory Antigen Receptor,CoStAR)研发工程化TIL的技术, CoStAR分子由叶酸受体α(FRα)激活,在肿瘤微环境中提供强大的共刺激信号,可以提升TIL的增殖能力以及在肿瘤微环境中的活性。目前公司的拳头研发产品ITIL-306的首次人体试验采用无外源输注IL-2的临床方案,希望进一步提高安全性。
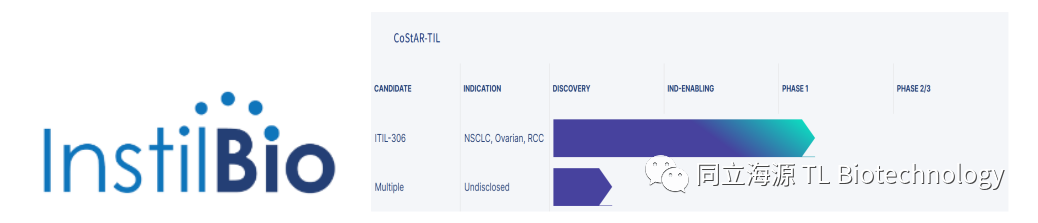
Fig3. Instil Bio在研管线
我国专注于TIL疗法的研发企业也在迅速发展,虽然起步较晚,但是我国相关企业在许多技术环节甚至已经达到国际领先水平,华赛伯曼CTO赵毅博士在接受采访时曾表示:“华赛伯曼利用穿刺方式获取病人肿瘤组织样本,仅0.01g即可实现后续至少90%成功率的细胞培养,作为参考TIL领军者Iovance公司则需要1.5g的样本。同时华赛伯曼的实验室且仅需16天就能扩增到治疗所需数量级的细胞进行回输,这无疑是一个巨大的领先优势。
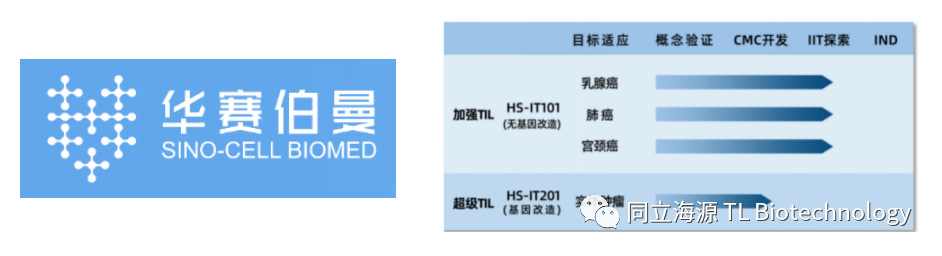
Fig4. 华赛伯曼在研管线
我国的TIL疗法领头羊沙砾生物已经在研发经过基因修饰的下一代TIL疗法,公司拥有三大核心技术平台:StemTexp®平台、ImmuT Finder®平台以及StaViral®平台。用于治疗转移或复发实体瘤的GT101注射液是国内首个获批临床的TIL疗法,其中ImmuT Finder®平台,已建立多个体内及体外肿瘤模型,能更好地模拟TIL在病人体内的真实情况,同时平台可以对TIL细胞进行全基因组的筛选,可以缩短过程至3个月,相较于目前其他公司选择的高通量筛选方法,极大的提高了筛选效率。

Fig5. 沙砾生物在研管线
除此之外劲风生物、君赛生物、西比曼生物、卡替医疗也在TIL领域快马加鞭推进研发进程。在这场群雄逐鹿的混战中,各家企业都有着自己的秘密武器,劲风生物致力于将生物信息学和人工智能技术融入自身的研发过程,已达到多元视角提高研发生产效率的目的;君赛生物在研的GC101TIL 是全球首个无需清淋、无需IL-2注射的天然TIL细胞治疗药物;西比曼生物的C-TIL051则获得了FDA批准,C-TIL051使用了公司专有的工艺,在人体内可以更快、更有效地达到临床剂量;卡替医疗研发的第四代产品——“超强型cTIL”,仅需采集外周血中的TIL细胞,极大地拓展了适用人群。另外资本方面,根据《2022创新药白皮书》显示2022年我国TIL融资事件共有3起涉及资金9.17亿元【2】。

自1986年Steve Rosenberg教授通过动物实验证明TIL的治疗有效性,到1988年发表的第一个TIL积极临床试验结果,短短几十年的研发进程,TIL凭借自身明显的优势,成为最有希望帮助人类攻克实体瘤的秘密武器。我国的TIL研发企业起步较晚,但是各个企业都力争在各个技术层面寻求突破,建立自身独特的市场竞争力,靠技术壁垒为自己争取一席之地。在免疫治疗势不可挡的发展趋势下,我们有理由相信目前临床在研的相关药物会给我们带来一个又一个惊喜。
针对TIL疗法快速发展的研究需要
同立海源具备细胞与基因药物(CGT)开发、验证、生产所需核心GMP级原料供应及定制化服务优势
欢迎大家垂询:400-010-5556

✦产品性能
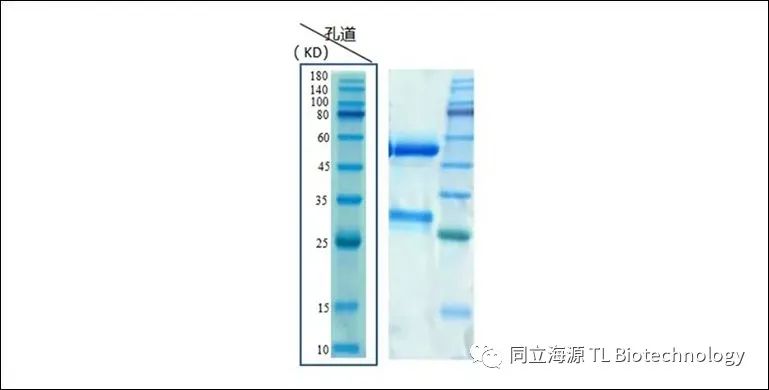
Fig1:CD3单抗纯度检测:SDS-PAGE
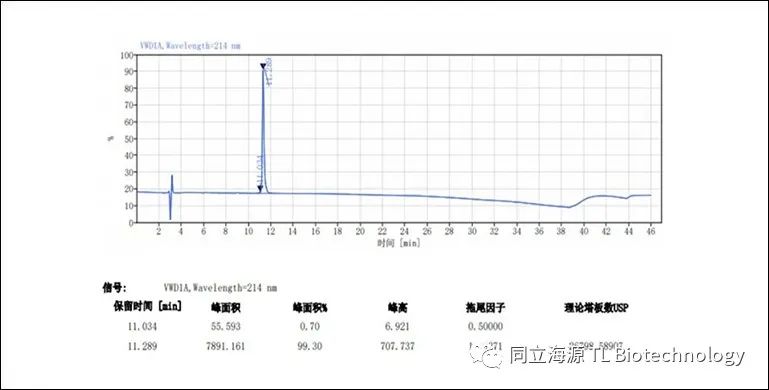
Fig2:CD3单抗纯度检测:HPLC
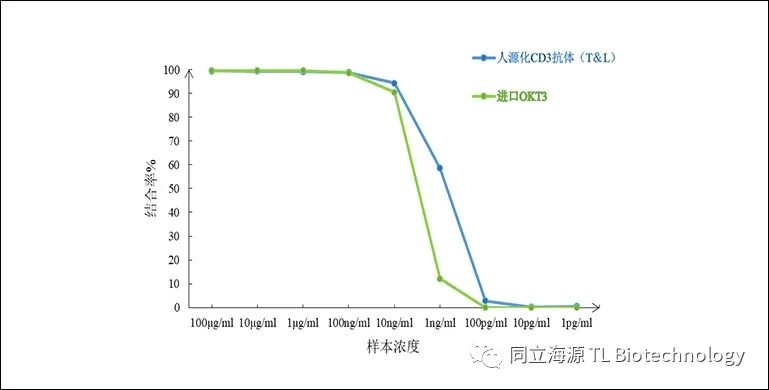
Fig3:CD3单抗与Jurkat细胞结合率
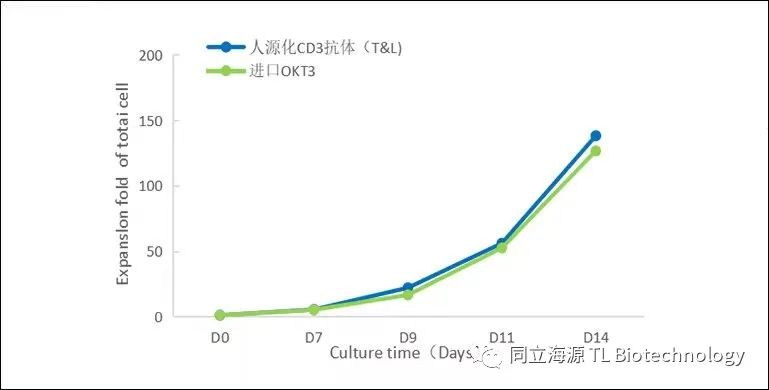
Fig4:T细胞增殖
✦产品性能
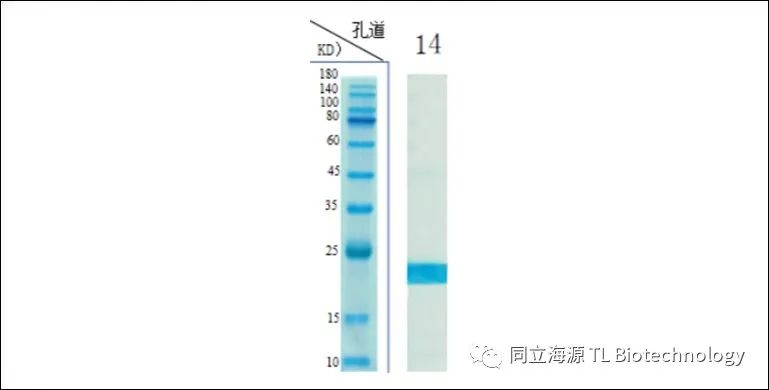
Fig1:IL-2纯度测试数据:SDS-PAGE
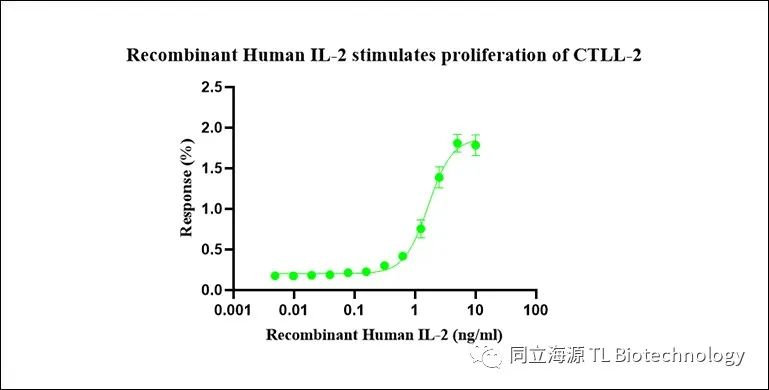
Fig2:IL-2活性测试数据
IL-7
✦产品性能
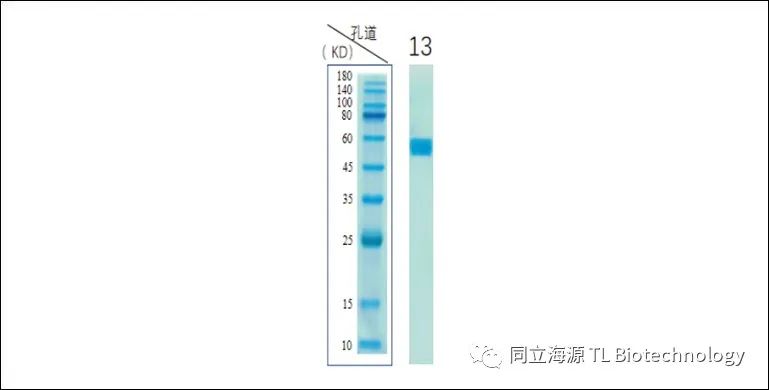
Fig1:IL-7纯度测试数据:SDS-PAGE
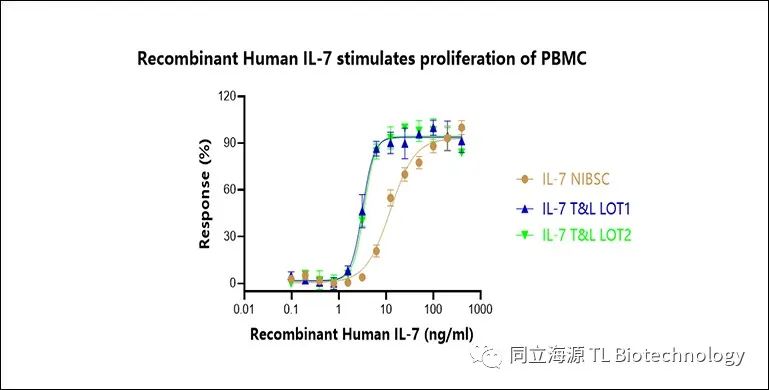
Fig2:重组人IL-7蛋白,可刺激PBMC增殖,比活性>1×107IU/mg(参考标准NIBSC代码:90/530)
IL-15

✦产品性能
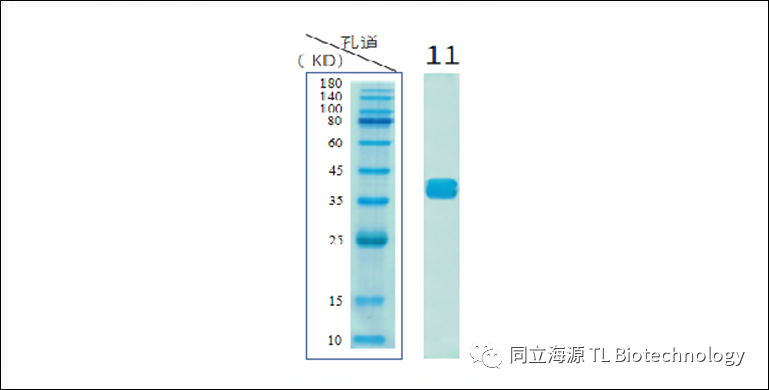
Fig1:重组人IL-15蛋白(长效型)纯度检测:SDS-PAGE
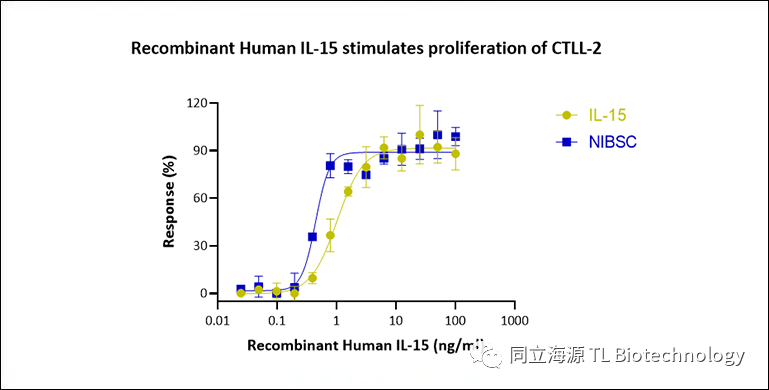
Fig2:重组人IL-15蛋白(长效型)可刺激小鼠T淋巴细胞CTLL-2增殖,比活性>5×106IU/mg(NIBSC代码:95/554)
解读文献:
【1】 Zhao Y, Deng J, Rao S, Guo S, Shen J, Du F, Wu X, Chen Y, Li M, Chen M, Li X, Li W, Gu L, Sun Y, Zhang Z, Wen Q, Xiao Z, Li J. Tumor Infiltrating Lymphocyte (TIL) Therapy for Solid Tumor Treatment: Progressions and Challenges. Cancers (Basel). 2022 Aug 27;14(17):4160.
【2】 《2022创新药白皮书》