

1983 年,Senger等发现豚鼠肝癌细胞分泌了促进血管内皮细胞生长的肽类物质,遂根据其生物学效应将其命名为血管通透因子(Vascular permeability factor, VPF);1989 年,Farrara等从垂体中分离和克隆了该类物质,并将其统一命名为血管内皮生长因子(Vascular endothelial growth factor, VEGF)。VEGF最开始的功能主要是促进血管内皮细胞增殖、血管形成以及血管通透性增加等作用,随着研究的深入,科学家们发现VEGF还具有免疫调节、神经保护、组织修复等多种功能。
VEGF家族成员
VEGF-A、VEGF-B、VEGF-C、VEGF-D、PGF
在人体组织中,血管内皮生长因子VEGF超家族由5个成员组成:VEGF-A、VEGF-B、VEGF-C、VEGF-D、PGF(planta growth factor,胎盘生长因子)。人们通常说的VEGF主要指VEGF-A。VEGF-A可促进新生血管形成和使血管通透性增加;VEGF-B在非新生血管形成的肿瘤中起作用;VEGF-C和VEGF-D在癌组织的新生血管和新生淋巴管的形成过程中起作用;PGF也是一种潜在的新生血管形成因子,PGF能促进新生血管形成,使血管通透性增加,在实验性脉络膜新生血管中PGF的表达明显增高[1]。

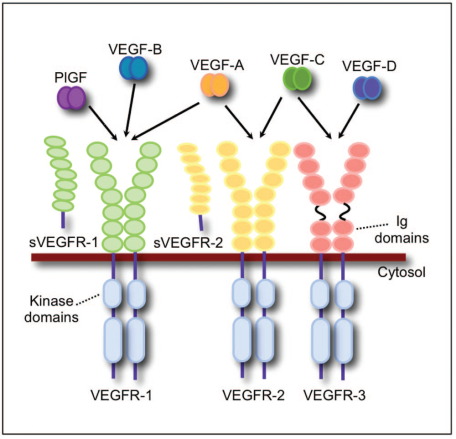
VEGF家族及受体成员
VEGF家族成员由多个外显子编码,在经溶解和与受体结合以后,经过剪切生成不同的亚型(比如:VEGF-A有七个亚型,VEGF-A基因转录形成的前体mRNA 通过可变剪接,可形成不同片段的VEGF-A 蛋白,分别为VEGF121、VEGF145、VEGF165、VEGF110、VEGF183、VEGF189和VEGF209等;而 VEGFB有VEGFB_(167)和VEGFB_(186)两个亚型),从而导致溶解度与受体结合位置出现一定的变化。
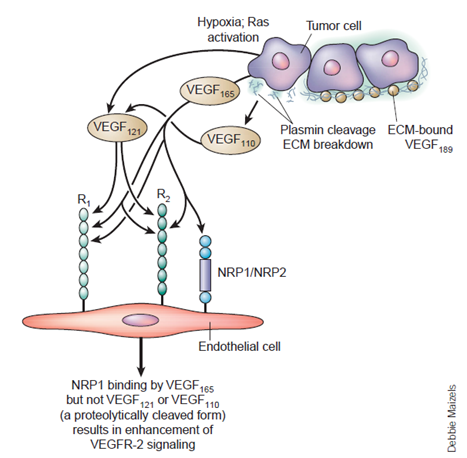
不同亚型VEGF-A与受体的结合
VEGF家族成员通过与膜结合的酪氨酸激酶受体来实现细胞内的信号转导:VEGF-A 和 VEGF-B有时候会更加倾向于和VEGFR-1受体结合;VEGF-A,VEGF-C, VEGF-D 与PGF有时候会倾向于和VEGFR-2受体结合;VEGF-C和VEGF-D有时候更加倾向于和VEGFR-3受体(仅仅是在造血细胞中表达)结合。
VEGF在新血管的形成中扮演着及其重要的角色。VEGF可以诱导已经存在的血管或者新生血管的发育,因此是胚胎发育和血管修复的关键。它会增加血管通透性,促进淋巴内皮细胞生长。
胚胎发育过程中,可观察到 VEGF 高表达。在此过程中,VEGF 与多种胚胎发育因子协同控制新血管的形成[2]。因此,如果生物体内的 VEGF 通路中断,由于循环问题导致的致死率将增加[3]。出生后,VEGF 的表达显著减少。但是,在进行伤口愈合或骨折修复的组织中,VEGF 的局部表达水平会上调[4]。
一旦血管生成开关经诱导后开启,将促进新血管形成,后续还会发生一系列复杂并且受到严密调控的反应。这种通路通过激活多种蛋白酶来促进已有血管周围的基底膜降解。随后,内皮细胞增殖作用加强,管腔和新的基底膜形成,新生成的血管相融合[4]。
VEGF应用研究
气道损伤修复、iPSC分化
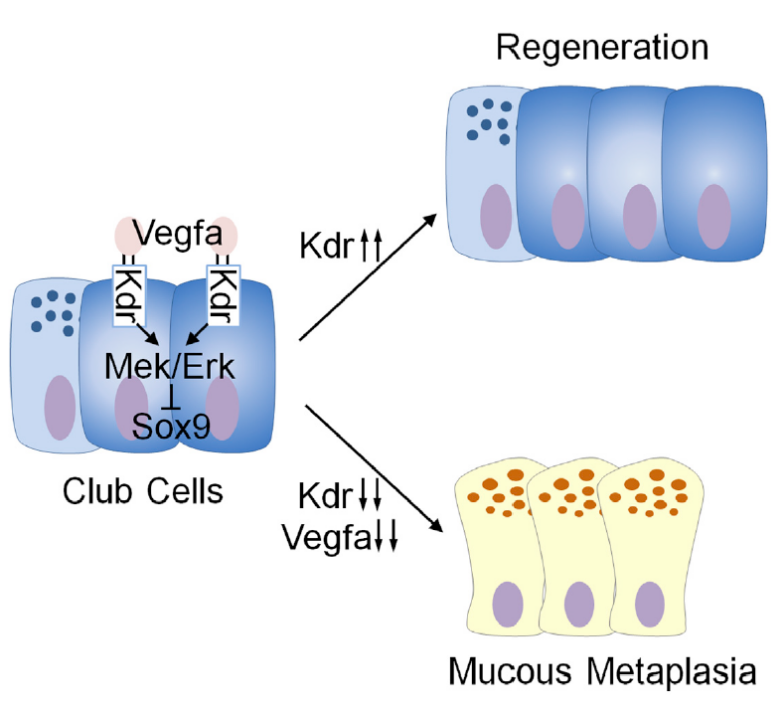
2021年5月18日,浙江大学医学院附属儿童医院蒋明研究员与哥伦比亚大学医学院阙建文教授在知名学术期刊《Developmental Cell》在线发表了论文“VEGF receptor 2 (KDR) protects airways from mucus metaplasia through a Sox9 dependent pathway ”[5],首次发现了血管内皮生长因子信号通路(VEGF signaling pathway)在肺气道上皮损伤后再生和气道疾病病理过程中起重要的调控作用,为此类疾病的治疗提供了新的思路和方向。

这项研究首次发现了VEGF信号通路在内胚层起源器官中的功能。不同于当前主流的炎症及免疫反应的作用,研究人员创新性地将VEGF信号通路引入了肺粘液化生发病机制领域。他们的发现对抑制呼吸道疾病的粘液化生提供了新的理论基础和治疗策略。
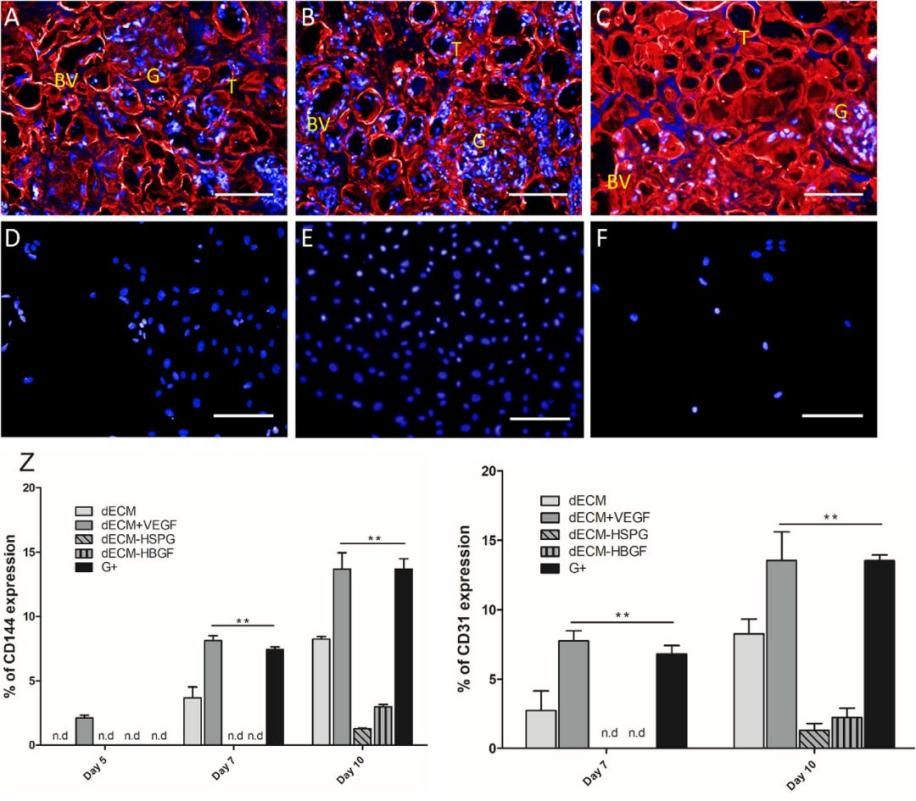
2019年6月18日,德国柏林夏里特大学Andreas Kurtz教授团队在《Biomaterials》期刊上发表了论文“VEGF-Supplemented extracellular matrix is sufficient to induce endothelial differentiation of human iPSC”[6]。Andreas Kurtz教授团队检测了dECM及其相关因子、血管内皮生长因子VEGF对人类诱导多能干细胞(hiPSC)向内皮细胞分化的调节作用。研究结果表明,清除HBGFs或ECM中的硫酸乙酰肝素蛋白聚糖(HSPG)会削弱dECM对hiPSC分化的诱导作用;相反,补充VEGF会增强dECM上hiPSC向成内皮细胞的分化。

为了证实去除HSPG和HBGF以及补充血管内皮生长因子(VEGF)对dECM的影响,研究者考察了HUVEC的生存能力和代谢活性。结果表明,HUVECs大部分位于肾小管和血管层粘连蛋白丰富的基质结构上,或毛细血管丰富的肾小球内,而在无基质成分的腔内区很少发现细胞。这种特异性在dECM + VEGF中最为明显,而在dECM- HSPG中,细胞呈现随机附着状态 。
VEGF关于肿瘤研究
肿瘤筛查、靶向药物
VEGF同样对于肿瘤生长具有促进作用,是肿瘤新血管生成中最重要的生长因子之一。1971年哈佛大学儿童医院J.FolKman教授带领的研究团队经过大量研究发现:在没有血管生成的情况下,实体肿瘤单纯依靠弥散获取氧气及营养物质,生长范围只能维持在1-2mm²;肿瘤组织生长范围超过2-3mm²时,必须依靠血管生成来提供足够的氧气和营养物质维持肿瘤组织的快速生长,血管生成是肿瘤生长和转移的基础,这就是著名的FolKman学说,1990年,这一假说也在业内得到证实。
VEGF表达量的监测可作为健康人群常规体检方式实现早癌筛查,早诊早治。VEGF也可作为临床科室的监测指标,以评估患癌的风险,提高癌症治愈率,降低医疗成本。针对有特异性肿瘤标志物的肿瘤类型(如AFP、PSA),联合VEGF检测能够明显提高临床诊断的灵敏度。
VEGF具备广谱性,能覆盖160余种组织类型癌种。它可以筛查几乎所有实体瘤和部分非实体瘤,联合其他肿瘤检测技术,能够显著提高肿瘤筛查的灵敏度。在影像学检测中,当肿瘤大小至少到1cm以上时才容易被发现,此时肿瘤细胞已达10亿级以上;免疫学检测在肿瘤细胞达到百万个以上数量时才可能被检出。VEGF在肿瘤形成初期就异常升高,检测VEGF对癌症风险的预警更早、更及时。
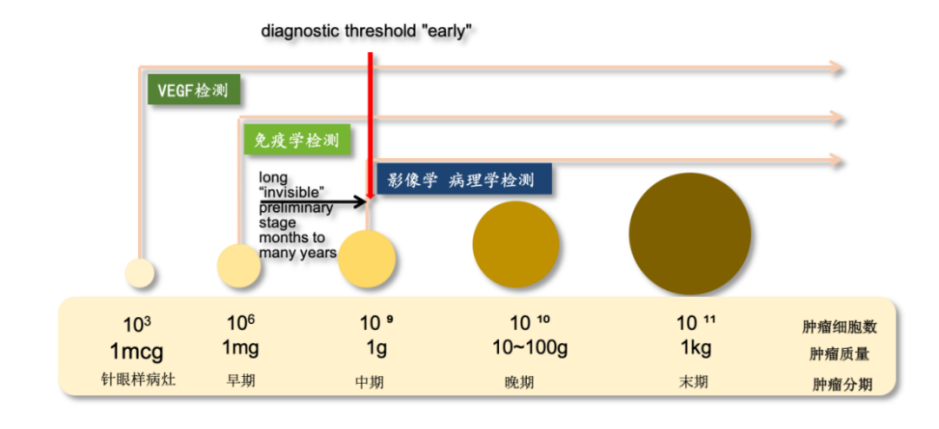
目前,由于多种癌症中VEGF信号通路的激活,已经有100多种抗体药处于各种研发阶段,而其中的多款单抗药物已经上市,针对这一靶点的双抗药物也在积极的开发中。覆盖的疾病包含了肿瘤特别是实体瘤、视觉性疾病以及心血管疾病等多种类型,具有很大的应用潜力。
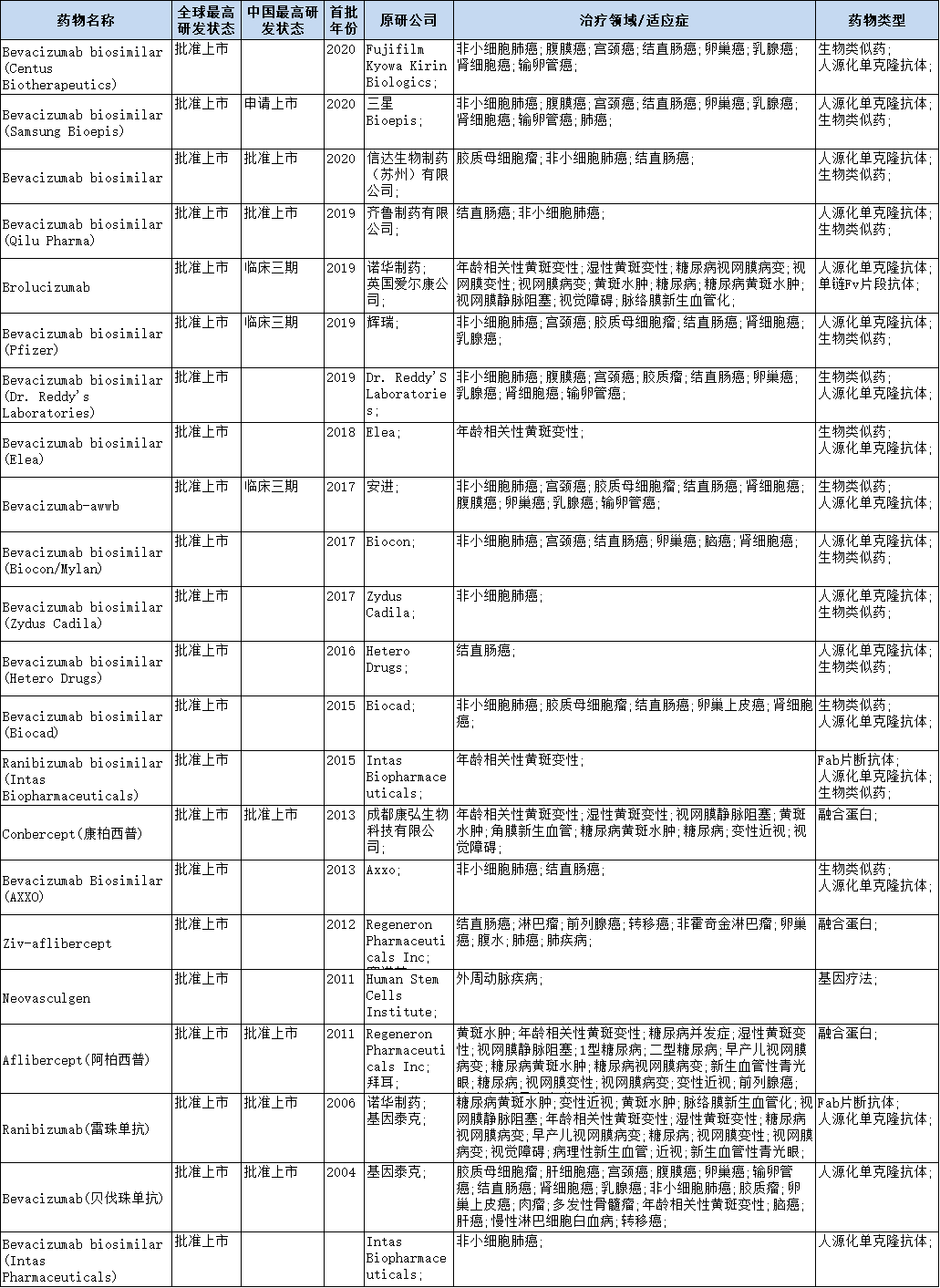
随着科研人员对VEGF在肿瘤治疗领域研究工作的深入,靶向调控VEGF通路已经在癌症治疗中显示出其临床应用的重要性。然而,需要注意的是,这些靶向药物也存在着一定的局限性。但VEGF信号传导途径仍然是癌症治疗的重要靶标,进一步了解这些药物的机制对于改善癌症患者的治疗至关重要。
综上所述,VEGF作为特异性最强的促血管生成因子,对促进受损器官及细胞修复具有重要意义。鉴于其在肿瘤血管及淋巴管生成和生长中的作用,以VEGF及其受体为靶向的抗肿瘤疗法有望成为抗肿瘤的重要手段。尤其值得一提的是,血管生成过程极其复杂,VEGF并不是唯一能够促进血管生成的因子,它与其他促血管生成因子的关系仍需持续关注和进一步研究。
参考资料:
[1]Samson M, et al. (2004) Human endocrine gland-derived vascular endothelial growth factor: expression early in development and in Leydig cell tumors suggests roles innormal and pathological testis angiogenesis. J Clin Endocrinol Metab, 89(8):4078–4088.
[2]Gilbert, SF (2000) Developmental biology (6th Edition). Sunderland (MA): Sinauer Associates.
[3]Ji Y, Lu X, Zhong Q, Liu P, An Y, Zhang Y, Zhang S, Jia R, Tesfamariam IG, Kahsay AG, Zhang L, Zhu W, Zheng Y (2013). Transcriptional profiling of mouse uterus at pre-implantation stage under VEGF repression. PLoS One. 8(2):e57287.
[4]Adair, TH and Montani JP (2010) Angiogenesis. San Rafael (CA): Morgan & Claypool Life Sciences; 2010.
[5]Ming Jiang,Yinshan Fang,Yu Li,Jianwen Que,et al. VEGF receptor 2 (KDR) protects airways from mucus metaplasia through a Sox9 dependent pathway.Developmental Cell.VOLUME 56, ISSUE 11, P1646-1660.E5,2021.
[6]Imran Ullah, Raed Abu-Dawud, Jonas Felix Busch, Anja Rabien, Bettina Erguen, Iris Fischer, Petra Reinke, Andreas Kurtz*. VEGF-Supplemented extracellular matrix is sufficient to induce endothelial differentiation of human iPSC. Biomaterials 2019, DOI: 10.1016/j.biomaterials.2019.119283.
北京同立海源生物科技有限公司,专注细胞和基因治疗(CGT)上游GMP级原料试剂研发及生产,为CGT用户提供产品与服务的整体解决方案。产品涉及细胞分选磁珠试剂、真核/原核重组蛋白、无血清培养基、细胞培养试剂盒等。
公司建有3200㎡的研发实验室及GMP级洁净车间,包括细胞分选磁珠开发平台、真核与原核蛋白表达工程平台、无血清培养基开发平台,通过ISO13485和ISO9001双质量体系认证,部分产品已获美国FDA DMF备案。
