喜报 国内首款!同立海源GMP级别分选磁珠DMF备案成功
美国DMF文件(Drug Master Files, DMF)备案是美国FDA认证为维护DMF申报中信息的机密性而做出的规定,内容包含用于人体的药物产品在生产、加工、包装和储存过程中用到的生产设施、工艺流程、质量控制及其所用原料、包装材料等详细信息,是全球药品制造商广泛参考的资源库,对于想要进入国际市场的原辅包厂家来说,进行DMF备案是非常必要的。
DMF备案主要目标是支持FDA监管要求并证明原料供应商的产品质量、安全性和有效性已获得所需的评级。原料供应商可以将与产品相关的机密信息直接提交给FDA,而无需向其客户披露。通常拥有大量DMF的供应商被认为在质量、监管地位和满足cGMP要求的能力方面更可靠。
通常药品在上市之前,申报者必须向FDA提出一系列申请,比如临床研究申请(IND)、新药注册(NDA)和生物制品许可证申请(BLA)等,并需要提供该药物在安全性、有效性和质量三方面的全部信息,其中涉及到原料药、辅料的相关技术内容,但是准备这些材料无疑会耗费大量的时间和精力,因此会严重影响临床申报的进程。
而DMF备案体系就可以解决这一问题,药物申报者可以直接使用DMF备案编号来代替申报过程中需要提供有关原料和辅料的具体信息,这样不仅可以节约审批成本,提高审批效率,保证监督检查能够溯源;同时极大程度上缩短了注册周期、减少由注册要求差异造成的重复性研究,进而加速药物申报进程。
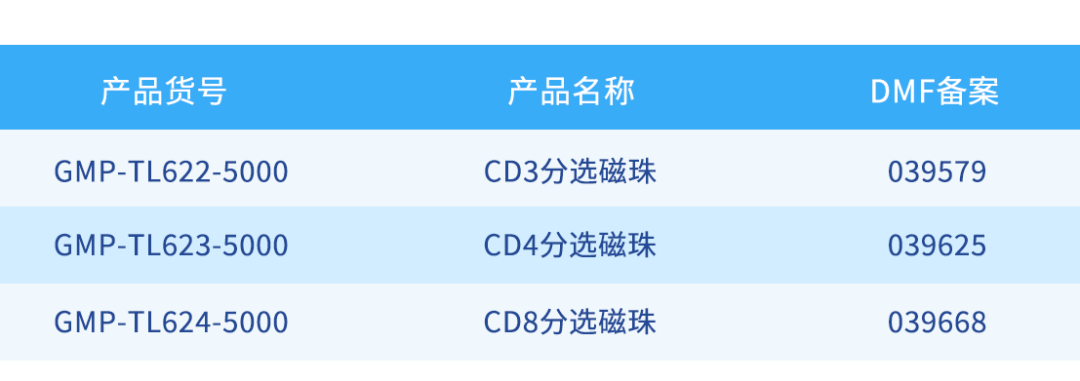
同立海源生物具备ISO9001和ISO13485双质量管理体系认证,B+A级洁净车间,从生产到质量控制放行始终遵循GMP标准,确保任何一款GMP级别细胞分选磁珠产品均可实现从性能,质量到体系要求对进口产品的完全替代。同立海源专注于细胞和基因治疗(CGT)GMP级原料试剂,已完成细胞治疗药物关键原料纳米级CD3、CD4、CD8细胞分选磁珠和ActSep系列微米级T细胞分选激活磁珠的DMF备案,助力您的药物申报进程。
GMP级别细胞分选磁珠兼具50nm“极致身形”,可温和高效地获得高纯度,高回收率的目的细胞,不影响下游应用。同时,可配套使用专有的无柱式技术自动化仪器,实现兼容无柱式分选,助力免疫细胞治疗产品的开发和生产,成为您进行临床转化的更优选择。