类器官是由干细胞或病人身上提取的肿瘤组织在特定的3D体外微环境下自组织发育而来的、高度模拟体内真实器官特征的小型化体外器官模型。与二维细胞培养和动物模型相比,类器官呈现出更加复杂的空间形态,可以更好地模拟组织器官的功能和生理反应。类器官技术的崛起,预示着新药研发进入了“低风险、低投入、高回报”的新纪元。
在中国,肝脏类疾病可能导致严重的肝功能衰竭和肝癌,治疗难度大,而历史肝病患者人数记录高达4.47亿,是最值得关注的高发病症之一。肝类器官技术即能够模拟酒精性肝病(ALD),也可以构建HBV感染的肝脏类器官系统,为肝脏疾病提供新的研究思路和治疗手段。
肝类器官培养通常需要四个阶段,iPSC培养和传代,iPSC向内胚层分化,肝内胚层分化,肝类器官培养与扩增分化。细胞因子作为肝类器官培养的基本原料,参与细胞的定向分化与增殖。
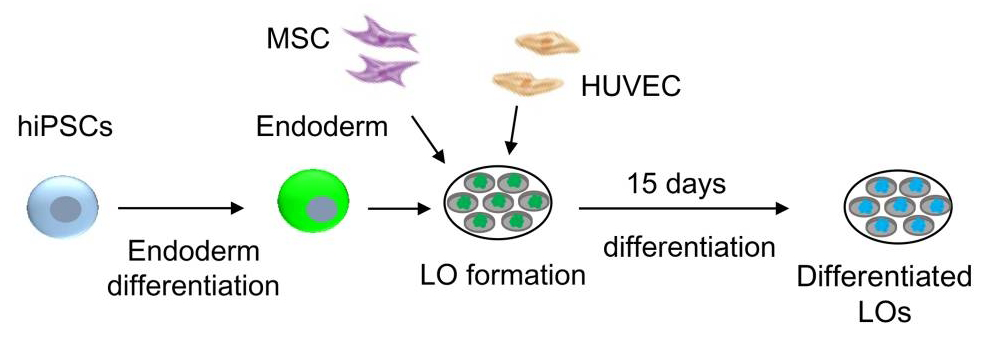
图1 肝类器官培养流程
第一阶段:iPSC培养和传代
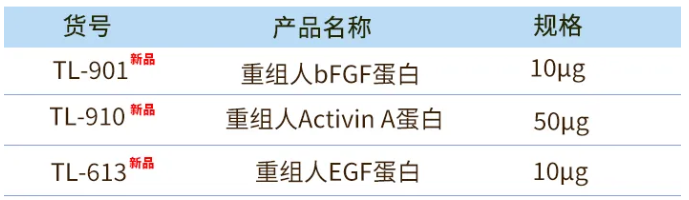
以多能干细胞作为起始样本,在包被明胶的培养皿上加入裂霉素处理过的小鼠胚胎成纤维细胞(MEFs)的细胞悬浮液,促进iPSC增殖并抑制其分化。随后将传代后的iPSC接种于明胶上并加入iPSC培养基,培养3-5天。重组人bFGF蛋白(Cat#TL-901)有效促进iPSC增殖。
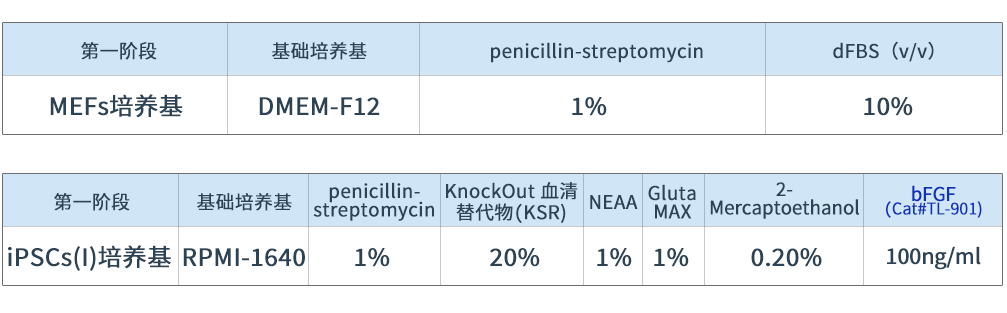
表1 肝类器官在第一阶段的培养基配制
在包被基质胶(Cat#AS-41-5)的培养皿中加入基础培养基,加入细胞消化液后离心并收集沉淀细胞。将收集的iPSC接种到包被基质胶的平板上过夜培养。随后,用DEs培养基换液并继续培养6天。重组人bFGF蛋白(Cat#TL-901)和重组人Activin A蛋白(Cat# TL-910)参与iPSC向内胚层分化。
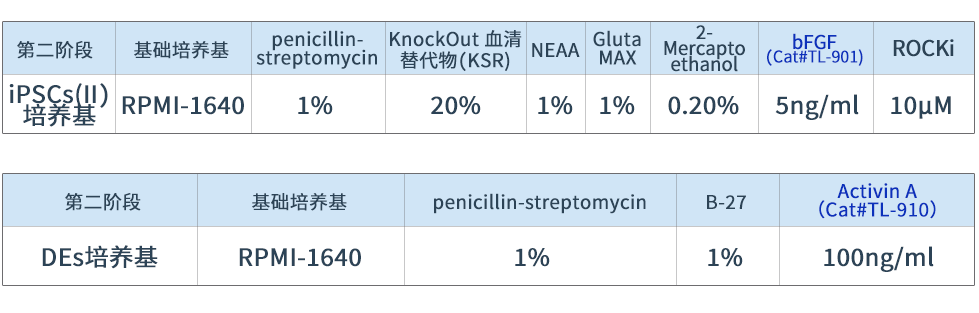
表2 肝类器官在第二阶段的培养基配制
第三阶段:肝内胚层分化
用HEs培养基换液并培养3天,用HEs(II)培养基换液并在低氧条件下培养4天,随后转移至常氧条件下继续培养8天。重组人bFGF蛋白(Cat# TL-901)参与肝内胚层分化。
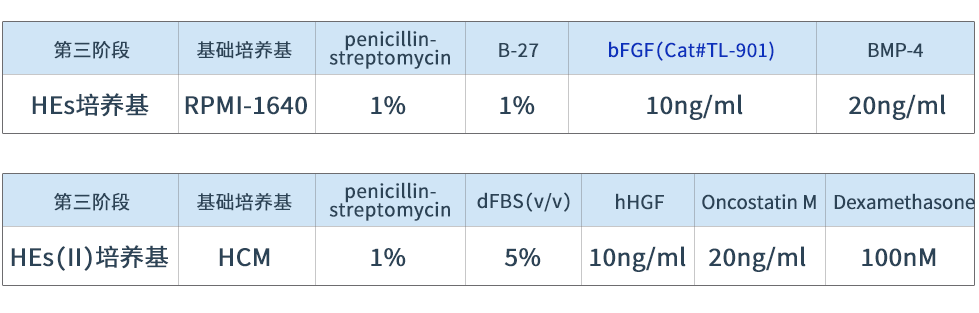
表3 肝类器官在第三阶段的培养基配制
第四阶段:肝类器官培养与扩增分化
在培养9-12天后,成熟的肝细胞会形成囊泡状结构,加入基质胶(Cat#AS-41-5)并添加HM培养基,定期更换培养基培养。用EM培养基替换HM培养基,低氧条件下培养4天。用DM培养基替换EM培养基,常氧条件下培养6天。重组人bFGF蛋白(Cat# TL-901)和重组人EGF蛋白(Cat#TL-613)协助肝类器官的扩增与分化。
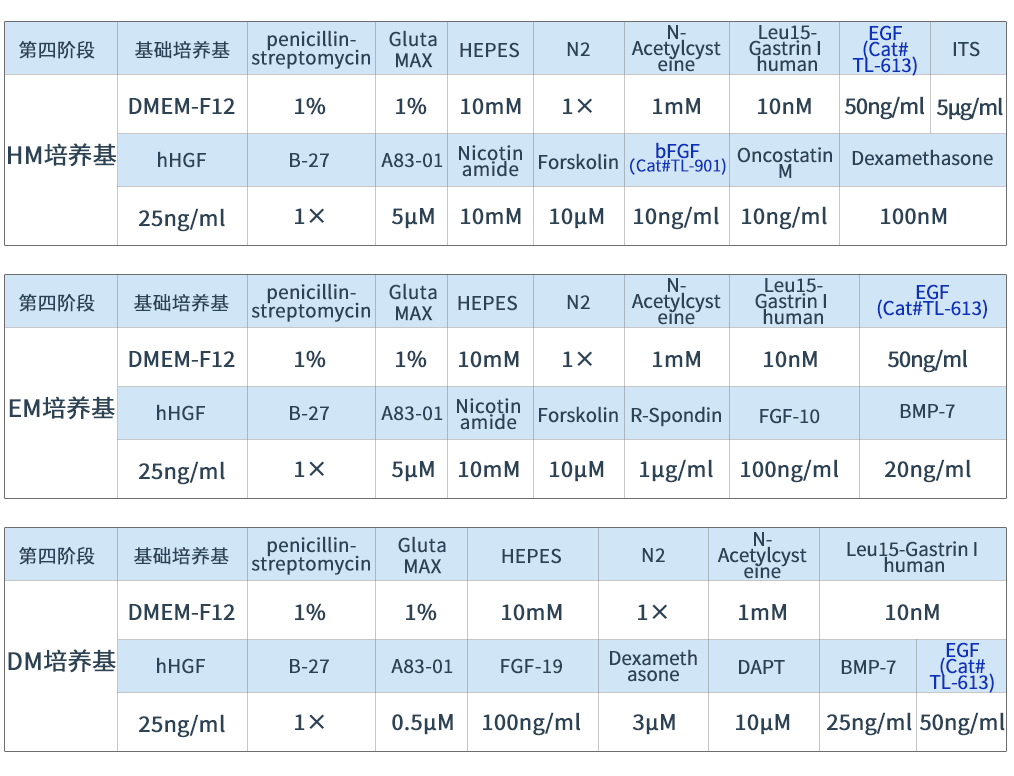
表4 肝类器官在第四阶段的培养基配制
产品特点
安全性能高:无LDEV(乳酸脱氢酶升高病毒)、细菌及支原体
浓度多样:浓度范围在8-20 mg/mL之间
低内毒素:内毒素含量<1.5EU/mL
性能稳定: 成胶性能稳定
采用COP瓶包装:可耐受-196°C低温储存、不易破碎、无蛋白吸附性、不易产生脱片立海源类器官相关新品重组蛋白推荐
参考文献
[1] 《2023-2024类器官技术与应用发展白皮书》医麦客
[2] 庄辉,我国肝病流行病学和疾病负担,中华医学会肝病学分会年会,中国-巴基斯坦联合肝病学术会议,2018年,中国厦门。
[3] Takebe T, Sekine K, Enomura M, Koike H, Kimura M, Ogaeri T, Zhang RR, Ueno Y, Zheng YW, Koike N, Aoyama S, Adachi Y, Taniguchi H. Vascularized and functional human liver from an iPSC-derived organ bud transplant. Nature. 2013 Jul 25;499(7459):481-4. doi: 10.1038/nature12271. Epub 2013 Jul 3. PMID: 23823721.
[4] Mun SJ, Ryu JS, Lee MO, Son YS, Oh SJ, Cho HS, Son MY, Kim DS, Kim SJ, Yoo HJ, Lee HJ, Kim J, Jung CR, Chung KS, Son MJ. Generation of expandable human pluripotent stem cell-derived hepatocyte-like liver organoids. J Hepatol. 2019 Nov;71(5):970-985. doi: 10.1016/j.jhep.2019.06.030. Epub 2019 Jul 9. PMID: 31299272.
[5] Nie YZ, Zheng YW, Miyakawa K, Murata S, Zhang RR, Sekine K, Ueno Y, Takebe T, Wakita T, Ryo A, Taniguchi H. Recapitulation of hepatitis B virus-host interactions in liver organoids from human induced pluripotent stem cells. EBioMedicine. 2018 Sep;35:114-123. doi: 10.1016/j.ebiom.2018.08.014. Epub 2018 Aug 16. PMID: 30120080; PMCID: PMC6156717.
[6] Ouchi R, Togo S, Kimura M, Shinozawa T, Koido M, Koike H, Thompson W, Karns RA, Mayhew CN, McGrath PS, McCauley HA, Zhang RR, Lewis K, Hakozaki S, Ferguson A, Saiki N, Yoneyama Y, Takeuchi I, Mabuchi Y, Akazawa C, Yoshikawa HY, Wells JM, Takebe T. Modeling Steatohepatitis in Humans with Pluripotent Stem Cell-Derived Organoids. Cell Metab. 2019 Aug 6;30(2):374-384.e6. doi: 10.1016/j.cmet.2019.05.007. Epub 2019 May 30. PMID: 31155493; PMCID: PMC6687537.
[7] Sgodda M, Dai Z, Zweigerdt R, Sharma AD, Ott M, Cantz T. A Scalable Approach for the Generation of Human Pluripotent Stem Cell-Derived Hepatic Organoids with Sensitive Hepatotoxicity Features. Stem Cells Dev. 2017 Oct 15;26(20):1490-1504. doi: 10.1089/scd.2017.0023. Epub 2017 Aug 24. PMID: 28699415.
[8] Bi G, Zhang X, Li W, Lu X, He X, Li Y, Bai R, Zhang H. Modeling alcohol-associated liver disease in humans using adipose stromal or stem cell-derived organoids. Cell Rep Methods. 2024 May 20;4(5):100778. doi: 10.1016/j.crmeth.2024.100778. Epub 2024 May 14. PMID: 38749443; PMCID: PMC11133832.