

干细胞疗法被视为21世纪的医学革命,已成为全球生命科学前沿最重要的研究领域之一。以干细胞技术为核心的再生医学作为时下生命科技突破的重点领域,也被誉为继药物疗法和手术疗法之后的第三次医学革命“高地”,而干细胞作为再生医学的重要分支,在很多临床难治性疾病的治疗上也展现了广阔的应用前景。尤其是在新冠病毒疫情爆发期间,干细胞已呈现出一定的医学应用潜力。根据海外市场咨询机构预计,2027年干细胞相关的行业产值将达到182.89亿美元。在新兴产业与市场消费的推动下,全球干细胞治疗的应用市场将出现强劲增长。
干细胞是一类原始的、未分化的细胞,具有自我复制和多向分化的潜能。干细胞有多种分类方法,按照分化潜能可分为:全能干细胞、多能干细胞和单能干细胞(或者专能干细胞);按照来源可分为:胚胎干细胞、诱导多能干细胞和成体干细胞。千变万化的干细胞具有许多特性,比如归巢效应,免疫调节能力、多向分化能力等,这也是干细胞具备临床应用前景的核心魅力所在。
细胞药物临床申报
近年来,国家药监局改革举措不断,其中不得不提的一点就是新药临床默示审批制度,这也为国内干细胞新药的开发提供了有力的支持和保障。目前,细胞治疗产品的开发路径有两种:一是申请为细胞制剂,按照药品管理相关法规进行研发和注册申报,由国家药品监督管理局(NMPA)按照药品进行监管,申报和审批后再进行临床试验;二是申请为医疗技术,由国家卫健委进行备案监管,备案通过后再进行临床研究。
目前,细胞治疗药物从研发到上市的路径已经十分清晰,具体过程详见下图:

细胞治疗产品开发最全流程图,兴德通制图
国内已受理干细胞新药
据国家药品监督管理局药品审评中心(CDE)官网最新数据显示,截至目前,CDE已受理了48个干细胞相关新药申报项目,其中2022年新增了9个干细胞新药申报项目。而2022年以来被CDE受理的9个干细胞新药申报项目中,有8款干细胞新药使用的是围产期组织脐带来源间充质干细胞,1款为人源脂肪间充质干细胞,且这9款申报的干细胞新药均为间充质干细胞1类新药。
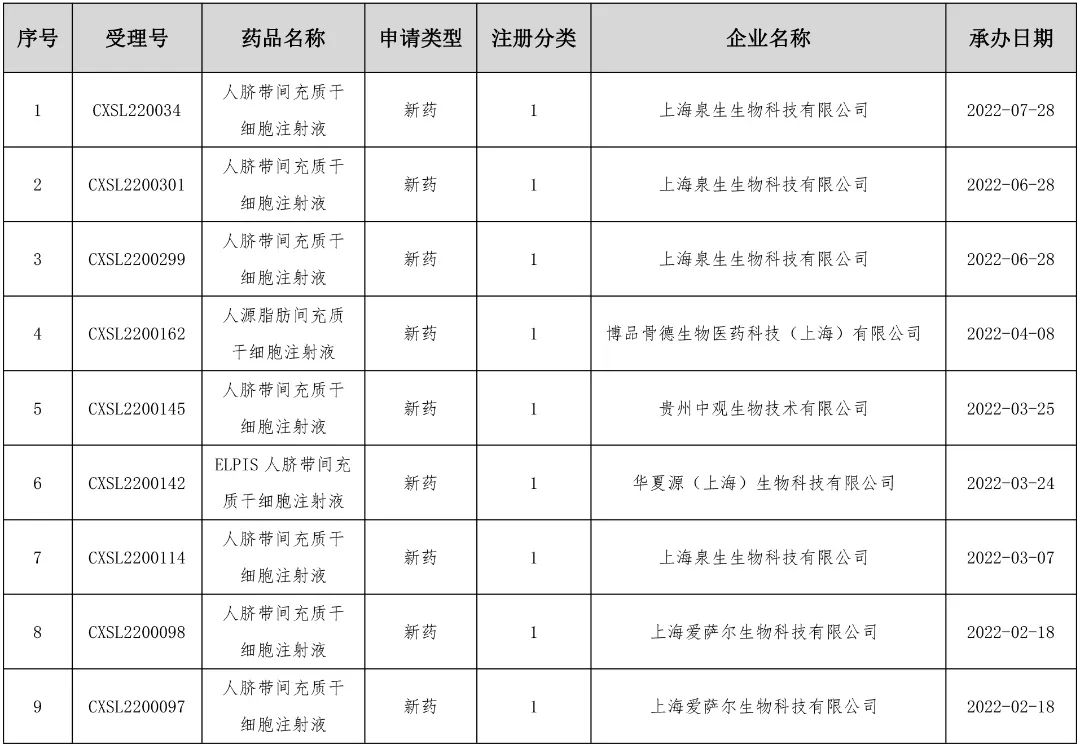
在CDE已受理的48个间充质干细胞的新药申报项目中,有27款新药已通过了临床试验默示许可。在27个受理品种中,以围产组织来源的脐带间充质干细胞为最多,多达17款。毫无疑问,脐带间充质干细胞新药是当前干细胞新药研发的热点,这得益于脐带间充质干细胞“通用”和“现货”两个特质。
受理干细胞药物临床应用
既然间充质干细胞这么重要,那么小编就在这里和大家简单科普一下间充质干细胞的发现史:1976年,Freidenstein等首次发现在骨髓里存在一群非造血的骨髓基质细胞,呈克隆性贴壁生长,形态和成纤维细胞相似。由于这些细胞具有多能性,可以分化为中胚层组织,如肌肉、肌腱、韧带及脂肪组织等。1988年,Freidenstein和Owen 将其命名为“骨髓基质干细胞”;1992年,Arnold Caplan教授将MSCs命名为间充质干细胞(Mesenchymal Stem Cells,MSCs),他也被业界称为“间充质干细胞之父”。
言归正传,在CDE注册的27款进入临床默示许可阶段的干细胞新药适应症涉及多种疾病的治疗,包括关节炎、重度狼疮性肾炎、缺血性脑卒中、银屑病、肺纤维化以及肝脏衰竭等多种疾病。
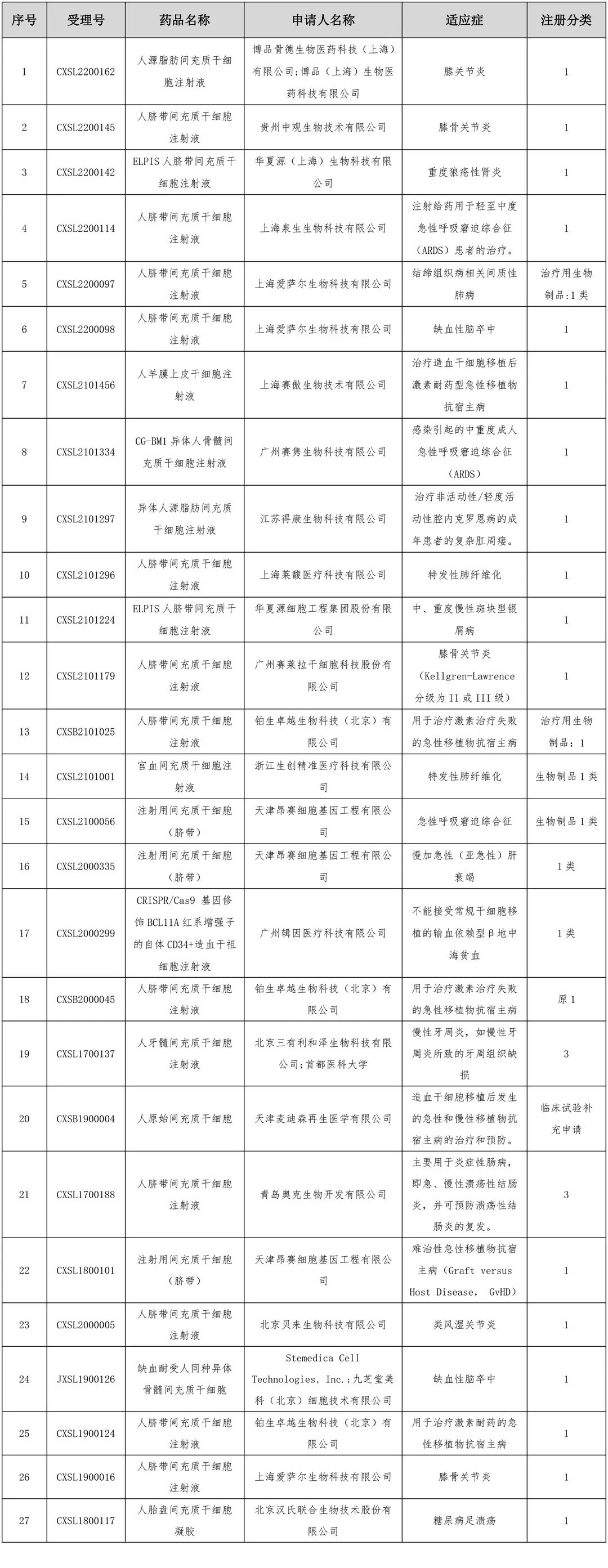
上市干细胞新药
在我国,虽未有成熟的干细胞药物获批上市,但一些国家已经有一些干细胞新药上市,相关数据显示,这些干细胞新药已达18款, 主要以欧盟、日本和韩国居多,美国的MACI自体软骨细胞新药备受争议。这些干细胞产品主要涉及的适应症有阿尔兹海默症、急性心梗、血栓闭塞性动脉炎、退行性关节炎等。

我国的干细胞药物研发之路任重而道远,其应用前景尚无天花板。目前,我国各级政府纷纷出台了大量细胞产业相关的监管和支持政策,国内细胞产业发展势头强劲。相信在不久的未来,我国细胞领域内的科研人员在政策、资金的加持下,持续突破技术壁垒,使干细胞药物在诸多未满足临床需求的疾病领域中发挥重要作用!
你想要的细胞状态在这里

同立海源干细胞相关产品推荐
01 、细胞培养试剂盒(AMMS®MSC试剂盒套装 2.0,货号AS-13)

02 、GMP级重组蛋白
关于同立海源
北京同立海源生物科技有限公司,专注细胞和基因治疗(CGT)上游GMP级原料试剂研发及生产,为CGT用户提供产品与服务的整体解决方案。产品涉及细胞分选磁珠试剂、真核/原核重组蛋白、无血清培养基、细胞培养试剂盒等。
公司建有3200㎡的研发实验室及GMP级洁净车间,包括细胞分选磁珠开发平台、真核与原核蛋白表达工程平台、无血清培养基开发平台,通过ISO13485和ISO9001双质量体系认证,部分产品已获美国FDA DMF备案。

