
近年来,随着基因编辑、基因改造等生物技术逐步成熟,细胞与基因疗法(CGT)发展突飞猛进,为肿瘤和罕见病患者带来了新希望。细胞与基因疗法(Cell and Gene Therapy, CGT)分为细胞治疗和基因治疗两大部分,通过改变细胞内的遗传信息,进而改变基因表达及相应的细胞性状,最终达到治愈疾病的目的。CGT凭借其在治疗机制和治疗效果等方面具有传统的小分子和大分子药物难以比拟的优势,填补了难治性疾病治疗手段的空白,为癌症、遗传病等难治性疾病提供了全新的治疗理念和思路,继而成为全球创新药领域竞争最为激烈的新兴领域之一。
图1. 细胞与基因疗法(CGT)治疗优势
早在1990年美国FDA就批准全球首个人体基因治疗的临床试验,但直到2017年FDA批准Spark Therapeutics的Luxturna,以及Novartis的Kymriah和Kite 的Yescarta上市开启了细胞和基因疗法新元年。截至 2021 年 6 月,中国正在开展的 CGT 临床试验约 100 项,CGT 药物全球商业化进程持续加快,在研 CGT 临床试验项目已近 2000 项。在技术、资本和政策的驱动下,全球 CGT 行业快速升温,根据 ASGCT(American Society of Gene + Cell Therapy,美国权威的细胞和基因治疗协会)的数据,截至2022年第一季度末已达到 1986 项。
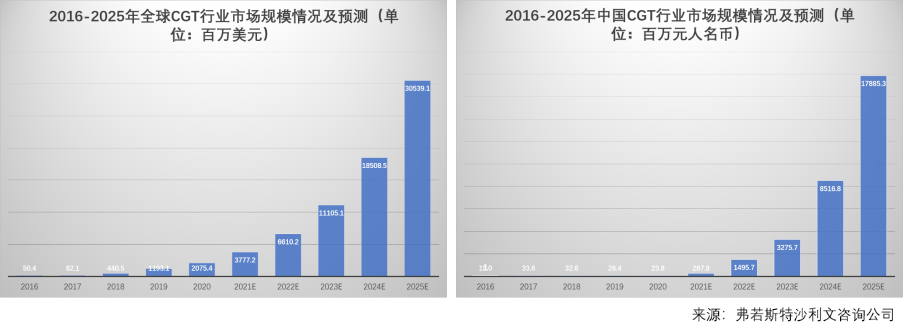
图2. CGT行业市场规模情况及预测
随着细胞与基因治疗进入快速发展期,细胞与基因治疗产品因其复杂性及特异性,不同类型产品制备工艺复杂程度、体内生物学特性及安全性风险、个体化应用等特性均与现有其他药品存在显著差异,给其监管法规体系的构建带来诸多挑战和不确定性。CGT是一种特殊的药物,作为药物的重中之重则是安全性问题。在此之前,CDE连发了四条指导原则,其中三条(《体外基因修饰系统药学研究与评价技术指导原则(试行)》《体内基因治疗产品药学研究与评价技术指导原则(试行)》和《免疫细胞治疗产品药学研究与评价技术指导原则(试行)》)对CGT生产过程中的质量控制提出要求。CGT生产流程复杂,质量控制难度大,产品质控是创新细胞与基因治疗产品研发中的一个重要内容,是决定产品能否进入临床研究以及顺利上市的重要环节之一。
01、CGT技术工艺路线
细胞与基因治疗技术工艺路线主要包含三个方面:质粒、病毒载体和细胞工厂,提升这三个方面的工艺开发技术、大规模生产能力,从而更好地进行质量控制和成本控制对于CGT用户至关重要。
质粒:细胞与基因治疗的关键起始物料和生产的主要成本来源。质粒是直接转染细胞或通过共转染组装病毒载体的重要原材料。根据使用目的、所选用病毒载体的不同,质粒的生产要求也不同。生产周期一般为7-10天。
病毒:高昂的生产成本是细胞与基因治疗商业化的痛点。生产病毒载体用以作为遗传物质递送系统。细胞与基因治疗领域常用的病毒载体包括逆转录病毒、腺相关病毒、腺病毒、慢病毒等。生产周期一般为2-3周。
细胞工厂:病毒载体和培养试剂是细胞疗法的成本所在。涉及细胞的培养、激活、转导、纯化、富集等步骤,根据细胞的来源可分为自体疗法与异体疗法。生产周期一般为10-15天。
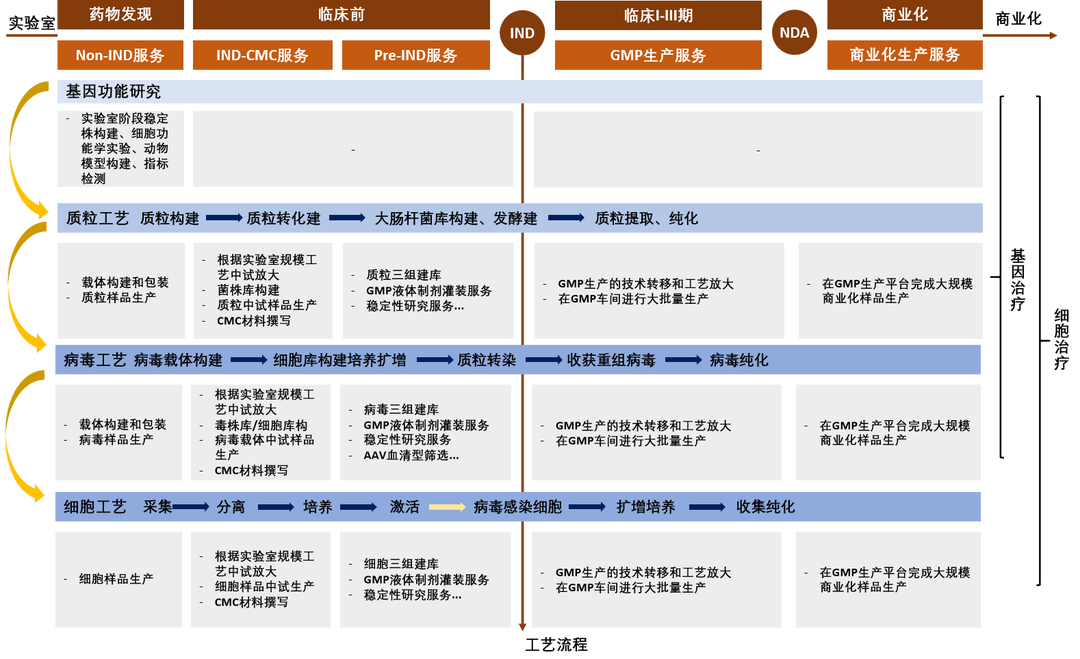
图3. CGT生产流程图
02、CGT治疗生产环节
细胞与基因治疗涉及的生产环节众多,主要流程包括:
采血:献血者或病人身上抽取全血,添加抗凝剂,分离血液成分,采集或去除特定成分,然后将未采集的成分回输给献血者或病人;
细胞分离:原始的细胞原液材料的分离分选、储备细胞制备;
细胞修饰:利用基因工程技术,通过逆转录病毒和慢病毒载体、转座系统或直接将mRNA转导到作用细胞(T或NK细胞等)内,使细胞表面表达嵌和抗原受体(CAR),拥有识别癌细胞和增殖的作用;
细胞扩增:在无菌环境中完成细胞培养相关操作,在相关试剂的辅助下实现细胞数量扩增;
质检:以流式细胞仪检测为主;
冻存:多以液氮存储系统为主。
03、CGT重要耗材
在CGT领域,耗材是生产成本的重要组成部分,生产CGT产品的耗材包括标准化的耗材和非标准化的耗材,前者如各类仪器所需管道、反应袋、色谱材料等,只要达到企业所需质量控制条件,不难在后期更换。一旦出现好的供应商,在不对工艺进行重大更改的情况下,企业有充足动力寻找更便宜的耗材来源。而对于非标准化的耗材,一旦更换可能造成工艺流程的变更,企业更换动力不大,尤其对于已申报IND进入临床后期阶段的项目,对生产稳定性的要求极高,部分耗材难以更换,比如CGT中不可避免要用到的细胞培养基和免疫磁珠等。
1. 细胞培养基:典型的非标准化耗材,目前用于细胞培养的培养基有四类,含血清培养基、无血清培养基、无动物来源培养基以及化学成分限定培养基。总的来看,CGT需要对细胞系培养(如生产慢病毒)和对原代细胞培养(如CAR-T),后者细胞更为敏感,也需要选用特定培养基。
2. 免疫磁珠:磁珠是CGT领域的重要试剂,几乎为外资垄断状态。磁珠在CGT领域有着广泛的应用,可用于细胞分选、免疫识别、核酸分离等流程。而在CAR-T生产中,磁珠一方面可用于T细胞的分选;另一方面包被CD3/CD28单抗的磁珠常用于T细胞的激活,与直接使用单抗的白细胞介素相比,磁珠激活方便,激活后的分离更易操作,且激活效率更高,产品表现稳定。
设备和耗材构成CGT的主要成本,而国内CGT行业的现状是多数我国CGT相关试剂原料长期被进口企业垄断,价格高、订货周期长,容易受到突发事件影响,在疫情爆发期间这个问题尤为明显,造成了行业“卡脖子”问题,限制了我国CGT行业的长期健康发展,加之医疗领域“十四五”规划实施方案的出台,加速实现细胞与基因治疗行业设备原料的国产替代迫在眉睫。此外,与传统生物药不同,细胞治疗用的是人的“活”细胞,不能通过过滤等手段除菌,或者获得CGT药物后再次处理应用,这就要求CGT药物在生产过程及原料辅料的选择上要尤为谨慎,保证CGT药物的安全性和有效性。在目前的情况下,CGT疗法大多来自于学术研究环境。在临床前阶段,使用的许多材料都标明仅供研究使用(RUO),而且通常成分不明确且不受控。在临床阶段,这些材料则必须替换为 GMP 级别的,但是在此阶段可能很难找到替代的供应商或具有同等性能的认证材料。当转为使用 GMP 级别的材料时,不仅会拖长研发时间,也会带来更高的研发成本。
同立海源生物十余年专注细胞与基因治疗(CGT)上游核心试剂原料的研发和生产,独具核心竞争力。通过ISO13485和ISO9001双质量管理体系认证,生产上严格执行药品标准,可为CGT用户提供高质量高活性的重组蛋白/GMP级细胞因子,免疫磁珠,细胞培养试剂盒,基因改造试剂/酶系列等产品,覆盖了包括细胞分离与激活、细胞改造、细胞扩增、细胞培养在内的CGT主要生产流程,具备更明显的价格优势,可保证货期,供应链稳定可控。此外,提供产品的同时,可以向客户提供技术层面服务,为细胞与基因治疗客户提供整体解决方案,助力CGT客户加快国产替代步伐,赢得市场先机。
关于同立海源
北京同立海源生物科技有限公司,专注细胞和基因治疗(CGT)上游GMP级原料试剂研发及生产,为CGT用户提供产品与服务的整体解决方案。产品涉及细胞分选磁珠试剂、真核/原核重组蛋白、无血清培养基、细胞培养试剂盒等。
公司建有3200㎡的研发实验室及GMP级洁净车间,包括细胞分选磁珠开发平台、真核与原核蛋白表达工程平台、无血清培养基开发平台,通过ISO13485和ISO9001双质量体系认证,部分产品已获美国FDA DMF备案。
